宝货配资
宝货配资
撰文 | 风
免疫检查点抑制剂(immune checkpoint inhibitors, ICIs ),如PD1/PD-L1以及CTLA4抗体,已经成为临床治疗的有效方法。然而,ICB目前面临的挑战是其仅在一部分患者中获得良好的治疗效果。因此,革新免疫系统活化的其他方法,例如靶向激动型受体,同样获得关注。作为TNF受体超家族成员,CD40在促进抗肿瘤免疫发挥重要作用【1】。CD40主要表达在抗原提呈细胞(antigen-presenting cells, APCs ),如巨噬细胞、树突状细胞和B细胞【2】。在配体结合时,如CD154和激动型抗体,CD40启动下游信号通路活化APCs,后者进一步激活T淋巴细胞参与抗肿瘤免疫【3】。在过去20年里,多个CD40激动抗体被开发和揭示其治疗机制,且已经在肿瘤 中测试(详见BioArt报道: ; ; ; ; )。然而,这些 抗体不仅疗效一般且存在剂量依赖毒性,包括验炎症风暴、血小板减少和转氨酶升高。前期研究发现CD40激动抗体的体内活性依赖于其抗体Fc段与 FcγRIIB 结合【4,5】。基于此,作者设计一个人源化CD40抗体,2141-V11,其具有5个突变位点导致与 FcγRIIB 亲和力增强【5】。体内实验证实相比于临床应用CD40抗体,2141-V11具有更强的免疫刺激能力,进一步促进DC激活和CD8 T淋巴细胞活化;2141-V11系统给药引起不良反应增多,但肿瘤局部给药可以降低不良反应发生率【5】。尽管如此,2141-V11仍缺乏临床研究数据。
近 日 , 美国纪念斯隆·凯特琳癌症中心的 Juan C. Osorio 和美国洛克菲勒大学的 Jeffrey V. Ravetch 团队 在 Nature Immunology 杂志 上发表了 题为 Fc-optimized CD40 agonistic antibody elicits tertiary lymphoid structure formation and systemic antitumor immunity in metastatic cancer 的 研究文章 。 该研究结合临床研究和模型小鼠,发现CD40抗体-2141-V11肿瘤内给药通过诱导三级淋巴组织增强机体抗肿瘤免疫进而发挥抗肿瘤治疗效果,进一步推进CD40抗体的临床应用研究 。

作者纳入12例晚期或者转移实体瘤患者,包括7例乳腺癌患者、3例黑色素患者和2例肾细胞癌患者。前期团队在非人灵长类动物中测试毒性发现 2141-V11静脉给药和皮下给药的最大耐受剂量分别是3 mg/kg/dose和100 mg/kg/dose。然而,人源化小鼠毒性试验发现2141-V11静脉给药和肿瘤内给药的最大耐受剂量则是0.1 mg/kg和0.3 mg/kg。这种差异可能是2141-V11与 FcγRIIB 的种属亲和力差异。因此,作者基于人源化小鼠数据,等价换算人剂量为0.03 mg/kg,3倍安全系数计算后为0.01 mg/kg。剂量递增按照标准3+3原则分别为0.7 mg、2 mg、7 mg和10 mg(对于体重为70 kg患者)。评估12例患者试验期间不良反应发现10例患者(83.3%)发生任何类型的不良事件,其中7例(58.3%)为治疗相关不良反应(TRAEs),无3级以上TRAEs。最常见TRAEs为发热、僵硬/寒战和注射部位反应,且主要发生在第3-4次药物注射。所有不良反应在治疗结束后均未持续存在,未观察到延迟性毒性反应。无患者出现血小板降低和肝酶增加。总体而言, 2141-V11在人体试验中表现出可接受的安全性特征。
对于治疗效果,6例患者出现肿瘤负担缓解,其中2例患者为完全缓解(CR),分别为乳腺癌和黑色素瘤,表明 2141-V11在部分患者中诱导完全缓解 。这两例CR患者分别为89岁黑色素瘤患者和67岁乳腺癌患者,两例患者 2141-V11 注射部位和非注射部位肿瘤均出现变小或消失且维持较长时间(反应持续时间分别为16.76月和7.1月),表明持续地原位和远距离抗肿瘤效果。外周血免疫细胞分析发现相比于非响应(non-responding, NR )患者,CR患者外周血CD8 + T细胞显著扩增,包括CD45RA + CCR7 - 效应、CD45RA - CCR7 - 效应记忆和granzyme B + CD8 + T细胞。此外,CD4 + 滤泡辅助T(Tfh)细胞增加,而其他CD4和B细胞则无区别。TCR-seq分析证实CD8 + T淋巴细胞克隆性扩增。总之, 2141-V11促进CD8 + T细胞介导的抗肿瘤免疫。
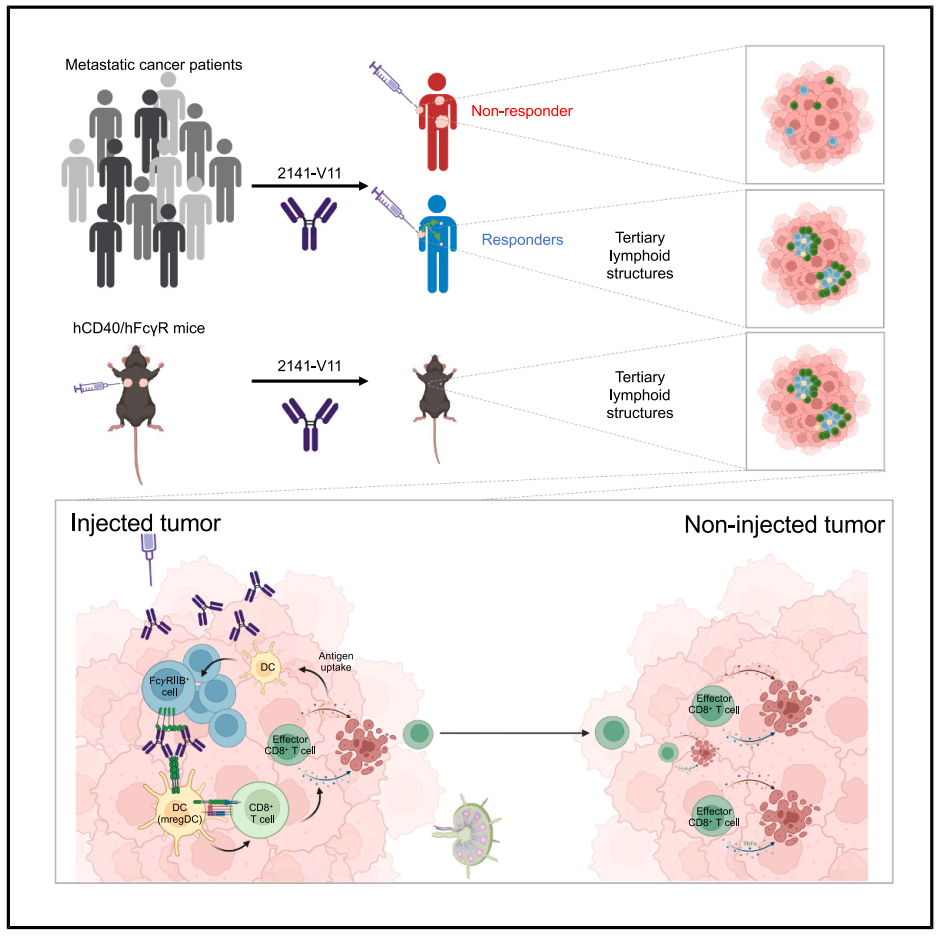
随后,作者从CR和NR患者获得肿瘤标本,行组织学和多重免疫荧光分析,发现CR患者肿瘤内CD4 + 、CD8 + 和B细胞浸润增加。有趣的是,这些免疫细胞与CD11c + 树突状细胞(DC)、CD21 + 滤泡DC和成熟B细胞有组织地聚集,提示成熟三级淋巴结构(tertiary lymphoid structures, TLSs )可能关联 2141-V11的治疗效果 。紧接着,作者在人源化hCD40/ hFcγR 小鼠E0071乳腺癌模型证实 2141-V11诱导保护性抗肿瘤免疫,且具有免疫记忆提供长期保护。多重免疫荧光也证实2141-V11诱导患者肿瘤出现的成熟TLSs。这种TLSs诱导能力也见于其他肿瘤模型,例如膀胱癌。这些结果表明 2141-V11在多种肿瘤中具有TLSs诱导能力。 前述结果说明CR患者肿瘤内B细胞浸润增加。然而,2141-V11治疗期间敲除B细胞并不能影响其抗肿瘤效应,且2141-V11治疗小鼠分离的B细胞过继实验表明B细胞无抗肿瘤效应,提示 2141-V11的治疗效果并不依赖于B细胞。
最后,作者研究TLSs的抗肿瘤效果。对存在TLS和无TLS的肿瘤行scRNA-seq分析发现TLS存在的肿瘤内CCR7 + DC显著扩增,其富集成熟标志(Cd40、Cd86和ccr7)和免疫调节分子(Cd274和Pdcd1lg2),类似于mregDC。谱系分析发现这些mregDC来源于cDC1。由于mregDC涉及抗原提呈和T细胞启动,作者发现 2141-V11诱导 肿瘤内CD4和CD8 T淋巴细胞明显扩增,且效应CD8 T细胞增多。TCR-seq进一步证实肿瘤内CD8 T细胞克隆性扩增。随后,作者使用FTY720阻止肿瘤引流淋巴结淋巴细胞的迁出,发现FTY720并不影响 2141-V11的抗肿瘤效果,仅废除非2141-V11注射小鼠的抗肿瘤表型 。总之,这些结果表明 2141-V11在TLSs中促进CD8 + T细胞活化发挥系统性抗肿瘤效果,且并不依赖肿瘤引流淋巴结迁出。
综上所述,这 项 研究 通过临床和模型小鼠证实Fc优化CD40抗体 2141-V11的抗肿瘤效果宝货配资,并进一步指出2141-V11通过诱导肿瘤三级淋巴结构形成并促进CD8 + T淋巴细胞活化扩增介导持久和系统的抗肿瘤免疫,为 CD40抗体的临床应用提供新的证据和优化方案。
https://doi.org/10.1016/j.ccell.2025.07.013
制版人: 十一
参考文献
1. Gregory L, Beatty., Yan, Li., Kristen B, Long.(2016). Cancer immunotherapy: activating innate and adaptive immunity through CD40 agonists.Expert Rev Anticancer Ther, 17(2), 0. doi:10.1080/14737140.2017.1270208
2. Jon D, Laman., Eric, Claassen., Randolph J, Noelle.(2017). Functions of CD40 and Its Ligand, gp39 (CD40L).Crit Rev Immunol, 37(0), 0. doi:10.1615/CritRevImmunol.v37.i2-6.100
3. Robert H, Vonderheide.(2019). CD40 Agonist Antibodies in Cancer Immunotherapy.Annu Rev Med, 71(0), 0. doi:10.1146/annurev-med-062518-045435
4. Fubin, Li., Jeffrey V, Ravetch.(2011). Inhibitory Fc γ receptor engagement drives adjuvant and anti-tumor activities of agonistic CD40 antibodies.Science, 333(6045), 0. doi:10.1126/science.1206954
5. Therapeutic Activity of Agonistic宝货配资, Human AntiCD40 Monoclonal Antibodies Requires Selective FcgammaR
学术合作组织
(*排名不分先后)

战略合作伙伴
(*排名不分先后)
转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。
BioArt
Med
Plants
人才招聘
近期直播推荐

点击主页推荐活动
关注更多最新活动!

顺发配资提示:文章来自网络,不代表本站观点。